Génériques, des médicaments comme les autres:
médicaments comme
les autres
Ou plus couramment ce qu’on peut entendre en pharmacie « un générique », tout le monde en parle et parfois lui donne des notions différentes, nous allons donc essayer d’apporter quelques précisions à ce sujet.
Le médicament générique est une notion aujourd’hui très encadrée : c’est une copie d’un médicament original, mais pas nécessairement une copie strictement identique. Il doit avoir la même composition qualitative et quantitative en principes actifs*, la même forme pharmaceutique que la spécialité de référence et démontrer la bioéquivalence avec cette dernière, c’est-à-dire la même biodisponibilité dans l’organisme et en conséquence la même efficacité (1) .
Selon l’OMS « organisation mondiale de la santé », Les produits pharmaceutiques théoriquement équivalents et interchangeables « génériques » doivent contenir les mêmes principes actifs, à la même dose et sous la même forme galénique et doivent satisfaire aux normes de la pharmacopée (2)
Ok c’est assez clair, sauf peut-être pour la pharmacopée, mais qu’est-ce donc cette pharmacopée ? Nous allons voir ensemble comment l’agence française l’ANSM « agence nationale de sécurité du médicament et des produits de santé » la définit :
 *Principe actif : ou substance active, est le composant du médicament responsable de l’effet thérapeutique
*Principe actif : ou substance active, est le composant du médicament responsable de l’effet thérapeutique
La Pharmacopée** est un ouvrage réglementaire destiné aux professionnels de santé qui définit, les critères de pureté des matières premières ou des préparations entrant dans la fabrication des médicaments (à usage humain et vétérinaire) voire leur contenant et les méthodes d'analyses à utiliser pour en assurer leur contrôle. L’ensemble des critères permettant d’assurer un contrôle de la qualité optimale est regroupé et publié sous forme de monographies. Ces textes font autorité pour toute substance ou formule figurant dans la pharmacopée : Ils constituent un référentiel opposable régulièrement mis à jour.
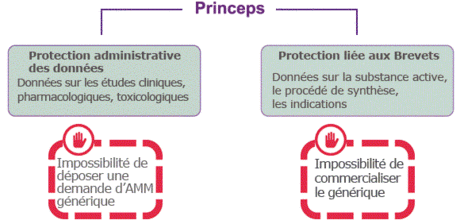
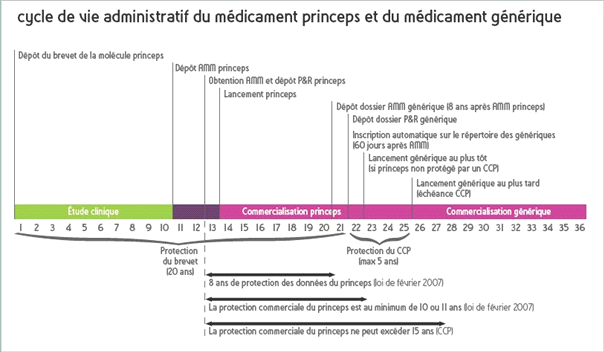
En Europe ; Dès qu’un organisme ou un laboratoire identifie une molécule prometteuse, il dépose un brevet qui protège sa trouvaille pendant 20 ans. Mais compte tenu de la durée du développement clinique et des procédures administratives pour commercialiser un médicament, la durée de protection du médicament se trouve réduite à peau de chagrin, ne dépassant pas 8 à 10 ans après l’autorisation de mise sur le marché (AMM).
Pour compenser ces années perdues, un certificat complémentaire de protection est parfois délivré pour une durée de cinq ans. Au final, la commercialisation d’un médicament princeps exclusif est donc garantie pendant 10 à 15 ans après sa mise sur le marché. Les données administratives du dossier d’AMM tombent quant à elles dans le domaine public huit ans après l’obtention de l’AMM : cela permet à des laboratoires de génériques de préparer leur copie en vue d’une commercialisation ultérieure, dès la chute du brevet du princeps.
En pratique, la commercialisation d’un médicament princeps est donc protégée environ une dizaine à une quinzaine d’années. Ensuite, ce médicament tombe dans le domaine public ouvrant ainsi la voie à la mise sur le marché de ses génériques autorisés.
L’efficacité et la sécurité du principe actif contenu dans le médicament générique ont déjà été démontrées pour le médicament d’origine. Les dossiers d’AMM des médicaments génériques n’ont donc pas à produire des essais cliniques.
La preuve de l’efficacité et de la sécurité du médicament générique est apportée dans le dossier biopharmaceutique par les données de biodisponibilité. L’évaluation de la qualité de l’étude de bioéquivalence d’un médicament générique fait partie intégrante de l’évaluation d’une demande d’AMM.
Un produit pharmaceutique générique est considéré comme essentiellement similaire au produit pharmaceutique original lorsqu’il a la même composition qualitative et quantitative en principe(s) actif(s), qu’il est présenté sous la même forme pharmaceutique et que, lorsque nécessaire, la bioéquivalence avec le premier produit a été démontrée par des études appropriées de biodisponibilité.


Le Laboratoire National de Contrôle des Produits Pharmaceutiques LNCPP a été désigné pour la première fois comme centre collaborateur de l’OMS pour la conformité des médicaments (CECOMED) en 2003, avec pour missions la formation pharmaceutique d’une part et l’expertise et le contrôle de qualité des médicaments d’autre part.
Cependant, pour les produits à index thérapeutiques étroit, ou posant problèmes de biodisponibilité ou possédant des caractéristiques pharmacocinétiques particulières, la commission nationale de nomenclature peut demander à ce que soit démontrée la bioéquivalence in vivo de la spécialité, objet de la demande d'enregistrement avec celle présente sur le marché.
Pour les médicaments importés, la réglementation Algérienne exige une étude de bioéquivalence lors de l‘enregistrement.

La taille du marché pharmaceutique Algérien était estimée à 3,3 milliards d’euros à fin 2016.
Intérêt pour la Population :
- Accès plus large aux médicaments,
- Moindre risque de ruptures de stocks,
- Économie pour les patients
Intérêt pour les Prescripteurs :
- Plus de choix pour les prescripteurs,
- Garantie de l’achat et de l’utilisation des médicaments,
- Meilleure observance, surtout en cas de pathologie chronique.
Intérêt pour la Santé publique :
- Volume importants de médicaments acquis pour le même budget.
- Les secteurs privé et public encouragent souvent l’utilisation des médicaments génériques afin de diminuer le prix des médicaments, améliorer leur disponibilité et les rendre plus accessibles aux consommateurs.
Enfin les génériques sont des médicaments efficaces et sûrs. Conçu à partir d’une molécule dont l’efficacité et la sécurité d’emploi bénéficient d’un recul d’environ 10 ans d’études et au moins 10 ans d’utilisation en pratique, le médicament générique est un médicament bien connu avant même sa commercialisation.
Bibliographie :
- ANSM. Médicaments génériques : lever l’opacité. Questions/Réponses. Décembre 2012.
- Site Web: http://apps.who.int/medicinedocs/fr/d/Jh1814f/3.4.3.2.html
- 3. https://www.inserm.fr/information-en-sante/dossiers-information/medicament-developpement
- Site Web ANSM: http://ansm.sante.fr/Dossiers/Medicaments-generiques/L-evaluation-des-medicaments-generiques/(offset)/1
- https://ansm.sante.fr/var/ansm_site/storage/original/application/980b4a8a5556688a4cf770416dc70434.pdf
- ANSM : https://www.ansm.sante.fr/afssaps/Dossiers/Medicaments-generiques/L-evaluation-des-medicaments-generiques/(offset)/1
- http://www.cci-sahel.dz/reglementation/les%20liens/Sante/D_cret_ex_cutif_92-284.pdf
- http://www.leconews.com/fr/depeches/pharmacie-le-marche-algerien-estime-a-3-3-milliards-d-euros-15-05-2017-180796_312.php
- http://www.fce.dz/wp-content/uploads/2015/08/developpement-march-mdicament-juin2012-.pdf






